Quimica:
El compuesto químico Acido nítrico (HNO3) es un
liquido viscoso y corrosivo que puede ocasionar quemaduras a los seres vivos.
DONDE
SE UTILIZA.
Es utilizado comúnmente como un reactivo de laboratorio. Se
utiliza para fabricar explosivos como la nitroglicerina y trinitrolueno (TNT),
así como fertilizantes como de esfe que reacciona con la mayoría de los metales
y en la síntesis química. Cuando se mezcla con el acido clorhídrico forma el
agua regia, un raro reactivo capaz de disolver el oro y el platino. El acido
nítrico también es un componente de la lluvia acida.
SÍNTESIS.
El acido nítrico se obtiene mezclando pentóxido de
dinitrógeno (N2O5) y agua. Sintetizar acido nítrico puro
impone habitualmente la destilación con acido sulfúrico. Ya que el acido
nítrico forma un azeótropo con el agua con la composición de del 68% de acido
nítrico y 32% de agua. Las soluciones comerciales incluyen entre 52% y un 68% de
acido nítrico se nombra como acido nítrico fumante y viene en dos variedades,
blanco y rojo. El acido nítrico blanco fumante también se llama 100% ya que
casi no tiene agua (menos de un 1%) según el proceso.
A nivel industrial, se fabrica mediante la síntesis de
amoniaco y oxigeno. Ambos elementos se combinan en un reactor de grandes
proporciones ante la presencia de un catalizador metálico. Debido a las altas
temperaturas que se soportan (700-900 grados Celsius), se utilizan metales que mantengan
sus características físicas a estas temperaturas, siendo el mas apropiado el
platino, en combinación con rodio (5-10%) que le aporta mas rigidez.
EQUIPO
DE PROTECCIÓN.
Para su manejo debe utilizarse bata y lentes de seguridad,
y si es necesario, delantal y guantes de neopreno o viton (no usar hule
natural, nitrilo PVA o polietileno). No deben usarse lentes de contacto cuando
se utilize este producto. Al trasvasar pequeñas cantidades con pipeta, siempre
utilizar propipetas, NUNCA ASPIRAR CON LA BOCA.
Acido Nitrico (HNO3)
Algebra:
HIBRIDACION:
SP2.
ANGULO:120°.
TIPO
DE GEOMETRIA:
TRIGONAL TIPO
DE ENLACE: COVALENTE
ESTRUCTURA
DE ENLACE: O N
O H
O
ATOMO
CENTRAL: NITROGENO(N).
Numero
de oxidación: 6
PARES DE ELECTRONES LIBRES: 2+4=6
ESTRUCTURA
DE LEWIS:
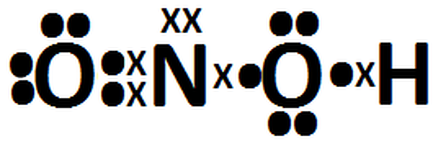
1
átomo de N = 5 e-
3
átomos de O = 18 e-
1
átomo de H = 1 e-
HNO3
= 24 e- externos
A nivel de
laboratorio, el ácido nítrico se puede preparar calentando nitrato de potasio
con ácido sulfúrico concentrado en un recipiente de vidrio.
KNO3 + H2SO4 → KHSO4 + HNO3
Otro proceso
utilizado para la generación de ácido nítrico se basa en la oxidación del
amoniaco en presencia de un catalizador y una posterior absorción en agua de los óxidos de nitrógeno generados.
BALANCEO.
COMPROBACION:
N2O+H2O 2HNO3 2 N
2
2 H 2
6 O 6
N2O5 H2O HNO3
∆H= 11 -285.830 -174.1
∆S=
356 69.950 115.6
ENTALPIA.
∆HF=∈∆HPRODUCTO→∈∆HREACTIVO
∆HF=[(2)(-174.1)]-[(1)(11)+(1)(-285.830)]
∆HF=-73.37 KJ/MOL.
VARIACION ENTOLPIA.
∆S=∈∆SPRODUCTO→∈∆HREACTIVOS
∆S=[(2)(155.6)]-[(1)(356)+(1)(69.950)]
∆S=-114.75 KJ/MOL.
ENERGIA LIBRE DE GIBBS.
∆G=∆H-T ∆S
∆G=[(-73.37)-(298.15)(-114.75)]
∆G=34139.34 KJ/MOL
Riesgos a la
salud
El acido
nítrico es una sustancia muy corrosiva en el contacto con los ojos y la piel, contacto respiratorio y contacto
digestivo no es una sustancia combustible pero promueve la combustión en otras
sustancias y cuando se le aplica fuego emite gases tóxicos e irritantes.
Acido Nitrico (HNO3)
Ingles:
chemical compound Nitric acid (HNO3) is a viscous
and corrosive liquid that can cause burns to living beings.WHERE IT IS USED.It is commonly used as a laboratory reagent. It is
used to make explosives such as nitroglycerin and trinitroluene (TNT), as wellas fertilizers such as esfe that reacts with most metals and chemicalreagent capable of dissolving gold and platinum. Nitric acid is also asynthesis. When mixed with hydrochloric acid, it forms the regia water, a rarecomponent of acid rain.SYNTHESIS.Nitric acid is obtained by mixing dinitrogen
pentoxide (N2O5) and water. Synthesizing pure nitric acid usually imposes thedistillation with sulfuric acid. Since nitric acid forms an azeotrope withsolutions include between 52% and 68% of nitric acid is named as fuming nitricwater with the composition of 68% nitric acid and 32% water. Commercialalso called 100% since it has almost no water (less than 1%) depending on theacid and comes in two varieties, white and red. Fuming white nitric acid isprocess.At an industrial level, it is manufactured by the
synthesis of ammonia and oxygen. Both elements are combined in a reactor of largeproportions in the presence of a metallic catalyst. Due to the highmaintain their physical characteristics at these temperatures, being the mosttemperatures that are supported (700-900 degrees Celsius), metals are used thatrigidity .appropriate platinum, in combination with rhodium (5-10%) that gives it morePROTECTIVE EQUIPMENT.For handling, we must use gown and safety glasses,
and if necessary, neoprene or viton gloves and apron (do not use naturalrubber, PVA nitrile or polyethylene). Contact lenses should not be worn whenusing this product. When transferring small quantities with a pipette, alwaysuse propipettes, NEVER MAKE A DUST WITH THE MOUTH.NAME OF THE FORMAULA: NITRIC ACID (HNO3).HYBRIDIZATION: SP2.ANGLE: 120 °.TYPE OF GEOMETRY: TRIGONAL TYPE OF LINK: COVALENTELINK STRUCTURE: O N O HORCENTRAL ATOM: NITROGEN (N). Oxidation number:PAIRS OF FREE ELECTRONS: 2 + 4 = 6LEWIS STRUCTURE:1 atom of N = 5 e-3 atoms of O = 18 e-1 atom of H = 1 e-HNO3 = 24 e- external
yeahh papus!!!!!yiiiii!!!!
ResponderEliminarya we te mojas :v
ResponderEliminar